Zawartość
Wzór cząsteczkowy to ważne dane w każdym związku chemicznym. Wskazuje, które atomy są w nim obecne, a nawet więcej, w jakiej ilości. Musisz znać wzór empiryczny, aby obliczyć wzór cząsteczkowy, i musisz zrozumieć, że różnica między nimi to mnożnik całkowity.
Kroki
Metoda 1 z 3: Wyprowadzenie wzoru cząsteczkowego z wzoru empirycznego
Poznaj związek między nimi. Wzór empiryczny określa względną proporcję atomów w cząsteczce - na przykład dwa atomy tlenu na każdy węgiel. Z kolei wzór cząsteczkowy wskazuje, ile z tych atomów jest obecnych w cząsteczce - na przykład jeden węgiel i dwa tlen (dwutlenek węgla). Oba są powiązane liczbą całkowitą, tak że wzór empiryczny pomnożony przez proporcję daje wzór cząsteczkowy.

Oblicz ilość moli w gazie. W tym celu należy zastosować prawo gazu doskonałego. Możesz określić ilość moli na podstawie danych dotyczących ciśnienia, objętości i temperatury obecnych w danych eksperymentalnych. Wielkość tę można obliczyć w następujący sposób:- W równaniu przedstawia ilość moli, ciśnienie, objętość, temperaturę (w kelwinach) i stałą gazową.
- Przykład:

Oblicz masę cząsteczkową gazu. Można to zrobić dopiero po określeniu ilości moli obecnego gazu (stosując prawo gazu doskonałego). Powinieneś także wiedzieć, ile gramów gazu jest obecnych. Następnie wystarczy podzielić ilość w gramach przez ilość w molach, aby określić masę cząsteczkową.- Przykład:

Dodaj masę atomową wszystkich atomów we wzorze empirycznym. Każdy atom w tym równaniu ma swoją masę atomową. Wartość tę można znaleźć u podstawy ramy atomu w układzie okresowym. Dodaj te wagi do siebie, aby określić wagę wzoru empirycznego.- Przykład:
Określ proporcje między masami we wzorze cząsteczkowym i we wzorze empirycznym. W ten sposób możesz określić, ile razy wzór empiryczny zostanie powtórzony w cząsteczce. Znajomość liczby powtórzeń pomoże ci zrozumieć liczbę sytuacji, w których wzór empiryczny przejawia się we wzorze cząsteczkowym. Dana wartość musi być liczbą całkowitą. Jeśli proporcja nie jest zaokrąglona w górę do liczby całkowitej, należy zaokrąglić wynik.
- Przykład:
Pomnóż wzór empiryczny przez stosunek. Pomnóż wzór empiryczny przez stosunek. Spowoduje to powstanie wzoru cząsteczkowego. Należy zauważyć, że dla dowolnego związku o stosunku „” wzory empiryczne i cząsteczkowe będą identyczne.
- Przykład:
Metoda 2 z 3: Określenie wzoru empirycznego
Znajdź masę każdego obecnego atomu. W niektórych sytuacjach zostanie podana masa każdego atomu. W innych będzie wyrażona jako procent masy. W takim przypadku można założyć, że jest to próbka zawierająca analizowany związek. Pozwala to zapisać procent masy jako samą masę, w gramach.
- Przykład:
Zamień masy na mole. Musisz przeliczyć masy cząsteczkowe każdego pierwiastka na mole. W tym celu konieczne jest podzielenie ich przez odpowiednią masę atomową każdego z nich. Możesz znaleźć tę wartość na dole tabeli dla każdego elementu w układzie okresowym.
- Przykład:
- Przykład:
Podzielić wszystkie wartości molowe przez najmniejszą. Konieczne jest podzielenie liczby moli odpowiadających każdemu pierwiastkowi oddzielonej przez najmniejszą molową ilość obecną w całym związku. W ten sposób możesz znaleźć proste proporcje do pracy. Działa to bardzo dobrze, ponieważ określa, że najmniejsza wartość jest równa „”, nadając pozostałym elementom względną proporcję.
- Przykład: najmniejszą ilością molową jest tlen z.
- Przykład: najmniejszą ilością molową jest tlen z.
Zaokrąglij wartości molowe do liczb całkowitych. Te liczby staną się subskrybowanymi wartościami w Twoim wzorze empirycznym. Musisz je zaokrąglić odpowiednio do najbliższej liczby całkowitej. Po tym ważnym ustaleniu możliwe będzie napisanie wzoru empirycznego.
- Przykład: wzór empiryczny to.
- Przykład: wzór empiryczny to.
Metoda 3 z 3: Zrozumienie wzorów chemicznych
Zrozum wzór empiryczny. Daje dane dotyczące stosunku jednego atomu do drugiego w danej cząsteczce. Nie ma jednak informacji dotyczących ilości atomów obecnych w cząsteczce. Wzór empiryczny nie dostarcza również informacji o strukturze i wiązaniach między tymi atomami.
Zrozum, co mówi ci wzór cząsteczkowy. Podobnie jak w przypadku wzoru empirycznego, wzór cząsteczkowy nie dostarcza danych na temat wiązań i struktury cząsteczki. Jednak podaje szczegóły dotyczące ilości każdego atomu w nim obecnego. Wzory empiryczne i molekularne odnoszą się do proporcji wyrażonej wartością całkowitą.
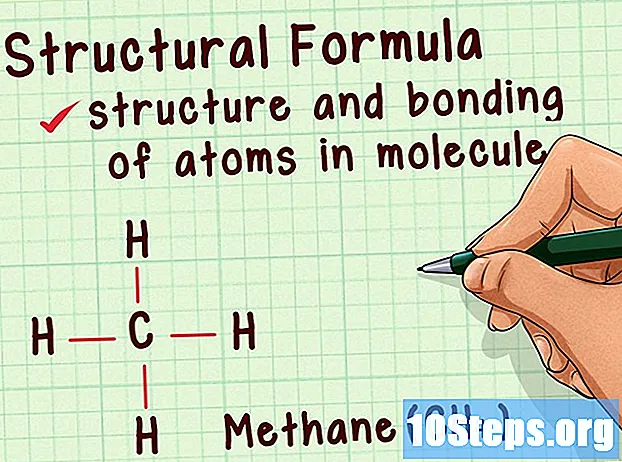
Zrozum reprezentacje strukturalne. Dostarczają jeszcze więcej informacji niż wzory molekularne. Oprócz ujawnienia ilości atomów obecnych w cząsteczce, reprezentacje strukturalne informują o wiązaniach i samej strukturze. Dane te mają kluczowe znaczenie dla zrozumienia reakcji cząsteczki.
Porady
- Przeczytaj uważnie pytanie (lub dane).
Ostrzeżenia
- Nie myl wzoru empirycznego z wzorem cząsteczkowym i odwrotnie.
Niezbędne materiały
- Układ okresowy pierwiastków;
- Kalkulator;
- Ołówek;
- Papier.